Research
- HOME
- Research
Research研究内容
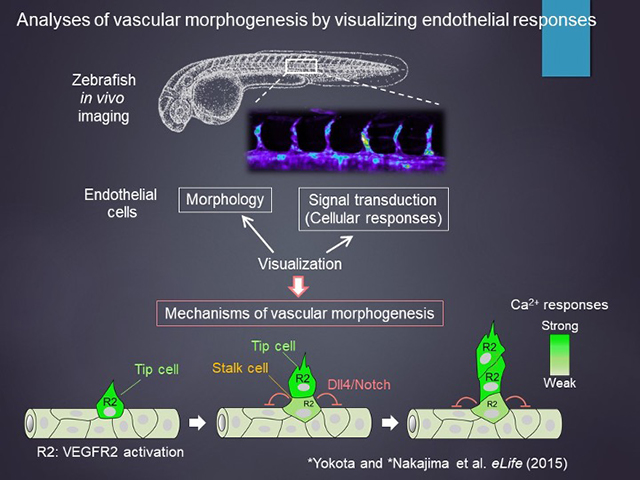
体内に隈なく広がる血管ネットワークを構築するためには、血管を構成する個々の血管内皮細胞が、時々刻々と変化する外部環境(分泌因子や力学的刺激など)に対して、適切に応答することが必要である。我々は、ゼブラフィッシュを用いた蛍光生体イメージングによって、個々の血管内皮細胞の形態を、直接の細胞応答である細胞内シグナル伝達と同時に可視化することで、動的な血管形成過程を動的なまま捉えて理解するというアプローチで研究を行っている。
これまでにも、血管新生で最も重要なシグナル伝達経路である血管内皮増殖因子VEGFA/VEGFR2シグナルの活性化を、その下流で応答する細胞内カルシウムのイメージングによって、生きたまま間接的に捉えることに成功している。それによって、血管新生過程のいつどこでVEGFR2シグナルが活性化し、それらが一連の抑制的シグナルによってどのように時空間に制御されているのかを明らかにしている(eLife, 2015)。
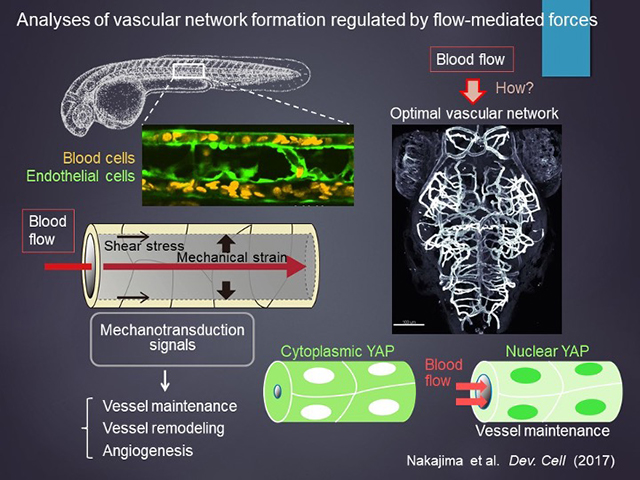
血管内部を流れる血流は、酸素や栄養などの運搬を行うのみならず、流れ自体が力学的刺激として血管内皮細胞に直接作用し、メカノトランスダクションと呼ばれる細胞応答を介して、血管の維持やリモデリング、血管新生に重要な役割を果たすことが知られている。我々は、血流による力学刺激がどのような力学的および化学的作用を介して、血管ネットワークの構築に寄与するのかを、血管構造・血管応答・血流の生体イメージングによって解き明かそうとしている。これまでにも特異的レポーターフィッシュを樹立することで血流に対する新たな細胞応答を捉えることに成功しており、それによりHippo経路の標的因子であるYAPが血流に応答して活性化し、血管の恒常性維持に寄与することを明らかにしている(Developmental Cell, 2017)。
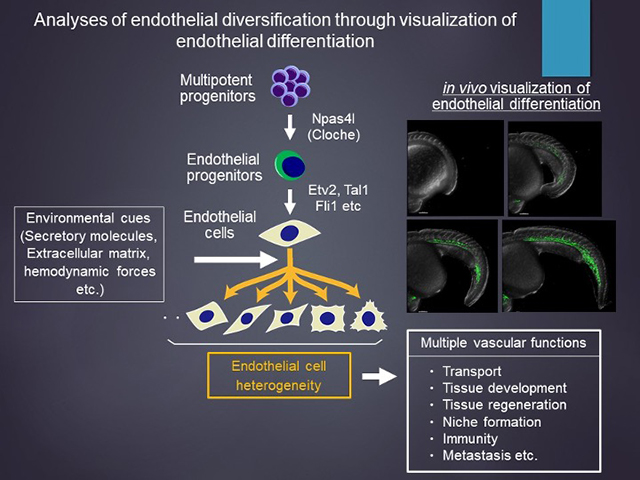
さらに我々は、血管内皮細胞がその起源となる多能性前駆細胞からどのように分化し、最終的に多様化した形質を獲得するのかを明らかにするための研究も行っている。血管内皮細胞は、局所的な分泌因子や細胞外マトリックス、力学的刺激などの環境因子に応答して、組織特異的な形質を獲得し、それによって多彩な血管機能が生み出されると考えられている。我々は、血管内皮細胞の分化過程をイメージングできる独自の系を開発しており、単一細胞レベルでのイメージング解析と単一細胞トランスクリプトーム解析を組み合わせることで、血管内皮細胞の多様性を生み出す新たなメカニズムの解明に迫っている。
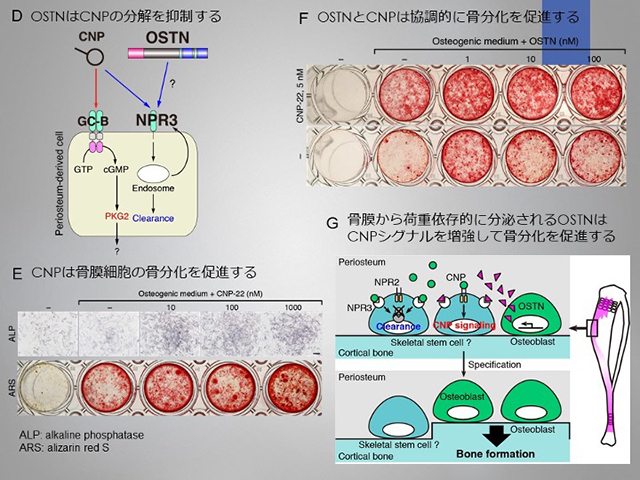
OSTNが駆動する新奇骨代謝メカニズムの解明
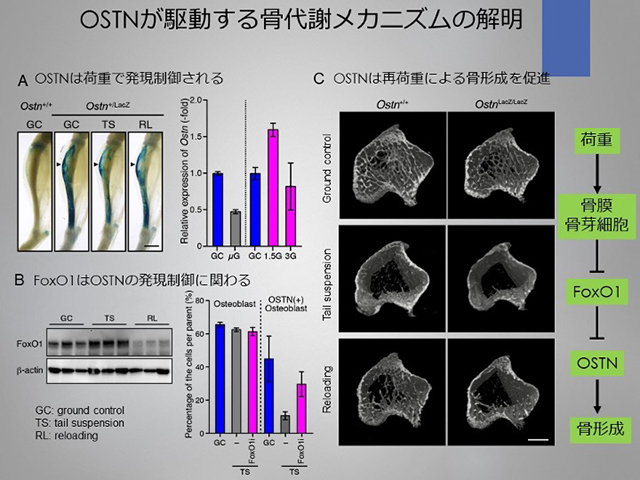
私たちの骨は骨芽細胞–破骨細胞–骨細胞のネットワークが生み出す絶妙な骨代謝バランスによって維持されています。しかし、微小重力環境下ではこのバランスが破綻して骨量が急激に減少します。私たちは荷重依存的な骨形成メカニズムの解明に取り組み、Osteocrin(OSTN)が荷重負荷のかかる遠位の骨から分泌され、荷重により発現制御を受けることを明確にしました。さらに、この発現制御は転写因子Forkhead box protein O1(FoxO1)が仲介することを明らかにしました。
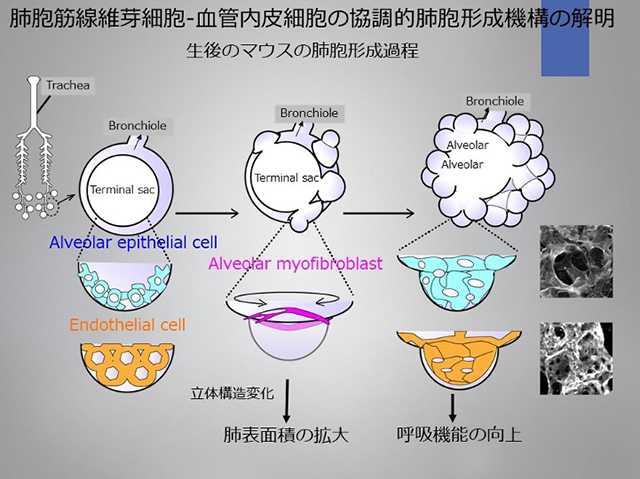
肺胞筋線維芽細胞-血管内皮細胞の協調的肺胞形成機構の解明
呼吸器感染症や肺気腫では肺胞の不可逆的変性が生じるために、根本的治療法として肺胞再生治療の開発が期待されていますが治療応用には至っていません。この原因の一つに肺胞形成が極めて複雑な現象であり、未だその機序が完全に理解されていないことが挙げられます。マウスの出生直後の肺は、気管支末端の終末嚢から構成され、いわゆる「肺胞」は存在しません。
しかし、生後3日から肺胞筋線維芽細胞が急激に出現し、終末嚢に隔壁を作ることによって多数の「肺胞」ができます。生後14日までには、成体の8割以上の肺胞形成が終了することが報告されています(図A)。この急速で劇的な肺胞形成過程では、platelet-derived growth factor receptor alpha (PDGFRa陽性の線維芽細胞が、II型肺胞上皮細胞が分泌するPDGF-A依存的に平滑筋aアクチン(a-smooth muscle actin, a-SMA)陽性の肺胞筋線維芽細胞へと分化し、強い収縮力を発揮して終末嚢を分割すると考えられています(図A)。
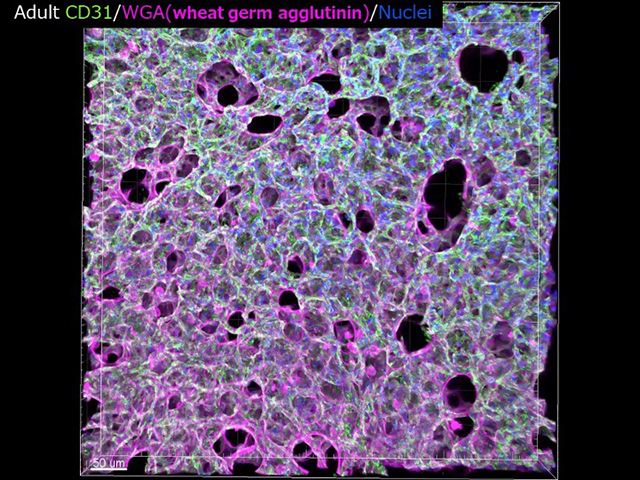
一方で近年、肺胞形成には毛細血管形成が必要不可欠であることが分かってきました。肺胞毛細血管は基底膜を介してI型肺胞上皮細胞を裏打ちするネット状の形態をとることが知られています。I型肺胞上皮細胞特異的vascular endothelial growth factor A (VEGF-A) KOマウスや血管周皮細胞(pericyte)特異的 angiopoietin-1(Ang-1) KOマウスでは、肺胞毛細血管が異常となり、隔壁が形成されないことが報告されています。しかし、隔壁形成は上述の肺胞筋線維芽細胞が担っており「血管新生異常がなぜ肺胞の隔壁形成を破綻させるか」は単純には説明できません。
そこで私たちは上記の機構について肺胞の3Dイメージングを用いて肺胞毛細血管の立体的解析から、肺胞形成機構における血管内皮細胞の役割を明らかにすることで、将来的に肺胞再生へと繋げていきたいと考えています。
如何にして心臓発生が正しく行われるのか、個体から分子レベルまで総合的に理解することを目指す上で、イメージング解析が不可欠である。
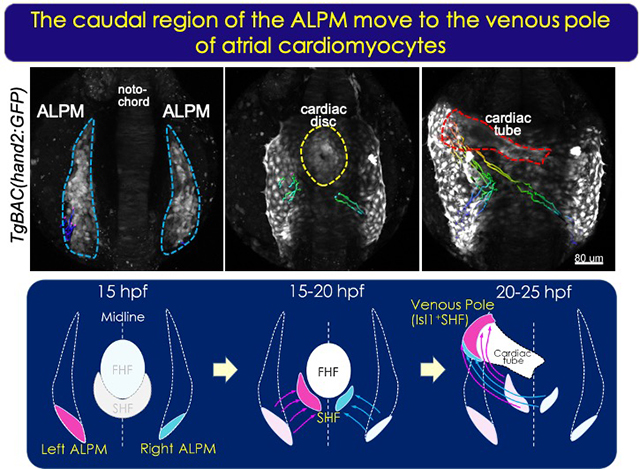
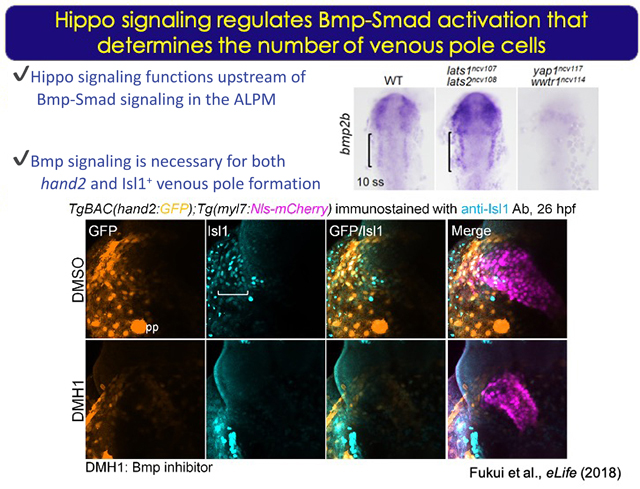
心筋細胞は一次心臓領域(FHF)と二次心臓領域(SHF)に由来する細胞から発生してくる。ゼブラフィッシュのSHFはIslet1 (Isl1) を発現する細胞から成り、流入路と流出路を構成する。我々は心臓発生過程を解析してきたなかで、心房流入路近傍でHippoシグナルのエフェクター:Yap/Wwtr1が活性化することを見出した。Yap/Wwtr1の抑制性キナーゼであるLats1/2を欠失した個体では心房筋細胞数が増加することが明らかとなり、この増加する細胞が流入路近傍を構成するIsl1陽性細胞であることを見出した。イメージング解析から作用点を辿っていくと、Bmp2bがHippoシグナルの下流で発現制御され、心筋の前駆細胞である前方側板中胚葉(ALPM)からの分化段階にHippoシグナル-Bmp/Smadシグナルが作用することを見出した。
また心臓発生過程では、遺伝学的に規定されたシグナル伝達だけでなく、血流や拍動といった力学刺激も必須の役割を担う。この力学応答機構について、拍動する心臓の高速イメージングや人為的な力学刺激などを駆使して精力的に解析を行っている。
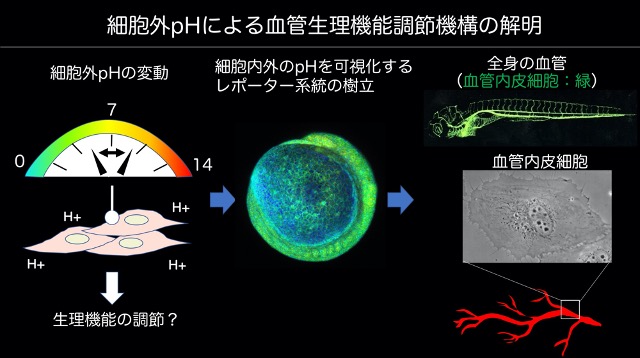
細胞外pHによる血管生理機能調節機構の解明
体内の細胞外酸性度(以下pH)は、細胞内の酵素やチャネル分子として機能するタンパク質の活性を至適に保つために、通常pH7.4付近に保たれている。細胞から排出されたプロトンや炭酸ガスは、血液を通して肺と腎臓に運ばれ、体外に排出されて全身性にpHが維持される。
一方で、局所的には、生理的な条件下でも血中pHは増減していると予想できる。しかし、局所で起きる血中pHの変化に対し、血液に直接晒される血管内皮細胞(以下内皮細胞)が、pHに応じた生理機能調節を行なっているかどうか、殆ど明らかにされていない。そこで内皮細胞のpH応答性を突き止めて、生体内で常に変動するpH条件下でどのように内皮細胞が機能しているのかを解明し、内皮細胞の新たな調節機構を理解したい。
我々は、細胞内外のpH変動をモニターできるプローブを全身性に発現するゼブラフィッシュ系統の樹立に成功した。今後、血管内皮細胞特異的なプロモータ下でプローブを発現させたゼブラフィッシュ個体や、培養細胞系を用いてpH変動と内皮細胞応答機能の関係を明らかにする予定である。
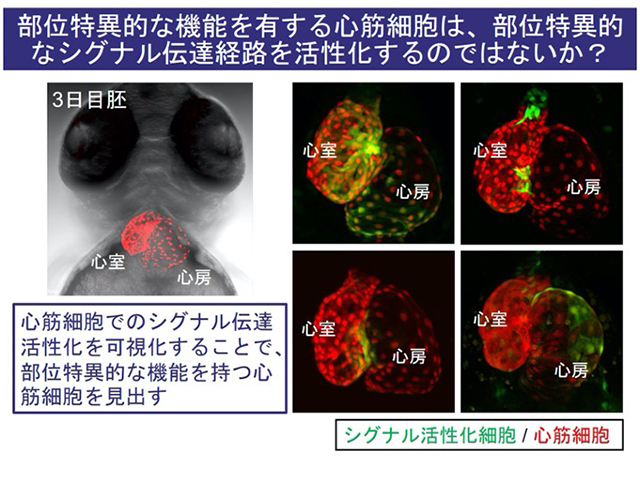
近年、シングルセル解析により、臓器内の細胞の多様性が注目されている。心臓も、多様な心筋細胞から構成されている。
ゼブラフィッシュの心臓は、一心房一単心室であり、哺乳類よりも単純な構造をしているが、様々な形態の心筋細胞から構成されている。私たちは、部位ごとに、異なる機能を有した心筋細胞が存在する可能性を考えた。そして、心臓内で特異的な機能を持つ心筋細胞は、特異的なシグナル伝達経路を活性化するのではないかと予想し、様々なシグナル伝達経路のレポーターゼブラフィッシュを観察した。その結果、シグナルごとに、特異的な部位での活性が観察された。
現在、部位特異的な機能を有する心筋細胞を見出すために、局所的な部位でシグナル伝達経路を活性化している心筋細胞について、その役割や、シグナル伝達による制御メカニズムを明らかにしようとしている。